Carbonsäuren
Grundlagen
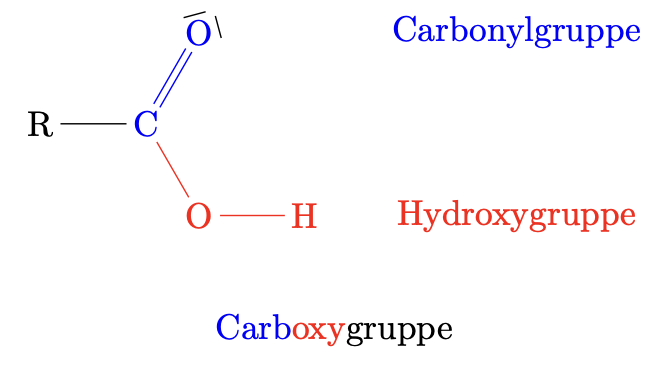
Carbonsäuren sind gekennzeichnet durch Anwesenheit einer Carboxygruppe $\ce{R-COOH}$.
Nomenklatur
Zur Benennung wird das Suffix -säure an den Namen des entsprechenden Alkans angehängt, wobei das $\ce{C}$-Atom der Carboxygruppe mitgezählt wird.
Homologe Reihe
Name |
Summenformel |
Halbstrukturformel |
|---|---|---|
|
Methansäure |
$\ce{CH2O2}$ |
$\ce{H-COOH}$ |
|
Ethansäure |
$\ce{C2H4O2}$ |
$\ce{CH3-COOH}$ |
|
Propansäure |
$\ce{C3H6O2}$ |
$\ce{CH3-CH2-COOH}$ |
|
Butansäure |
$\ce{C4H8O2}$ |
$\ce{CH3-(CH2)_2-COOH}$ |
Pentansäure |
$\ce{C5H10O2}$ |
$\ce{CH3-(CH2)_3-COOH}$ |
Hexansäure |
$\ce{C6H12O2}$ |
$\ce{CH3-(CH2)_4-COOH}$ |
Physikalische Eigenschaften
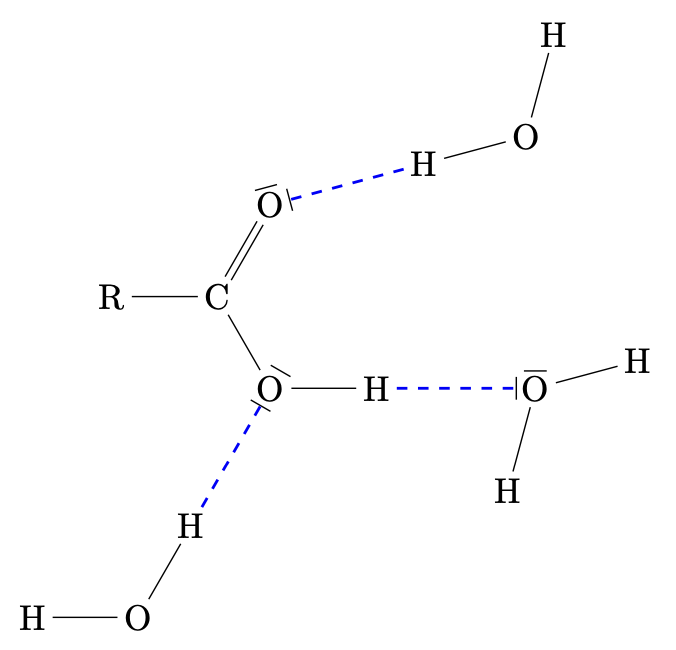
Zwischen den Carboxygruppen der Alkansäuren können Wasserstoffbrückenbindungen entstehen. Zwischen den Molekülen von Alkansäuren wirken starke zwischenmolekulare Kräfte.
Siedepunkte
Die Siedetemperaturen der Alkansäuren liegen noch einmal über denen der
Alkanole mit ähnlicher molarer Masse
Die Carboxygruppe der
Alkansäuren ist stark polar. Sie kann zudem jeweils zwei
Wasserstoffbrücken- bindungen mit anderen Carboxygruppe ausbilden. Die
Anziehungskräfte sind so stark dass jeweils zwei Alkansäuremoleküle eine
Tendenz haben, sich zu Doppel- molekülen (Dimeren) zu verbinden.
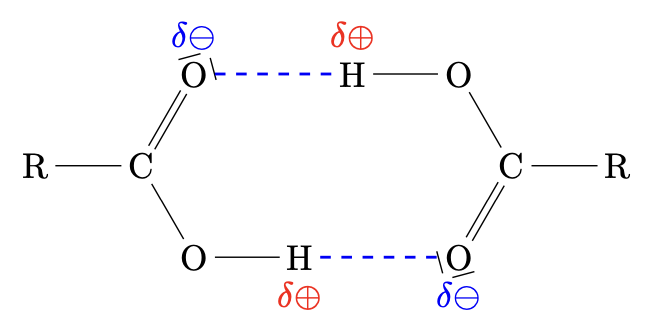
Die Siedepunkte der Alkansäuren liegen noch über denen der entsprechenden Alkanole.
Zwischenmolekulare Kräfte
Name |
Zwischenmolekulare Kräfte |
|---|---|
Alkane |
van-der-Waals-Kräfte |
Alkene |
van-der-Waals-Kräfte; |
Alkanale |
van-der-Waals-Kräfte; |
Alkanole |
van-der-Waals-Kräfte; |
Alksäuren |
van-der-Waals-Kräfte; |
Löslichkeit
Alkansäure |
Löslichkeit bei $20^{\circ} \frac{g}{L}$ |
|---|---|
Methansäure |
unbegrenzt |
Ethansäure |
unbegrenzt |
Propansäure |
unbegrenzt |
Butansäure |
unbegrenzt |
Pentansäure |
25 |
Hexansäure |
8,9 |
Heptansäure |
2,4 |
Octansäure |
0,68 |
Die ersten 4 Glieder der homologen Reihe der Alkansäuren sind unbegrenzt in Wasser löslich. Die Löslichkeit nimmt ab der Pentansäure mit zunehmender Länge des Alkylrests ab. Ab der Ethansäure lösen sich die Alkansäuren in jedem Verhältnis in Benzin.
Die niederen Carbonsäuren sind durch die Bildung von Wasserstoffbrückenbindungen zwischen Carboxygruppen und Wassermolekülen sehr gut löslich.
Mit zunehmender Länge des Alkylrests steigt der Anteil der van-der-Waals-kräfte an den gesamten zwischenmolekularen Kräften. Die Löslichkeit nimmt mit steigender Größe des Alkylrests ab.